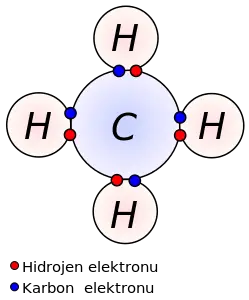
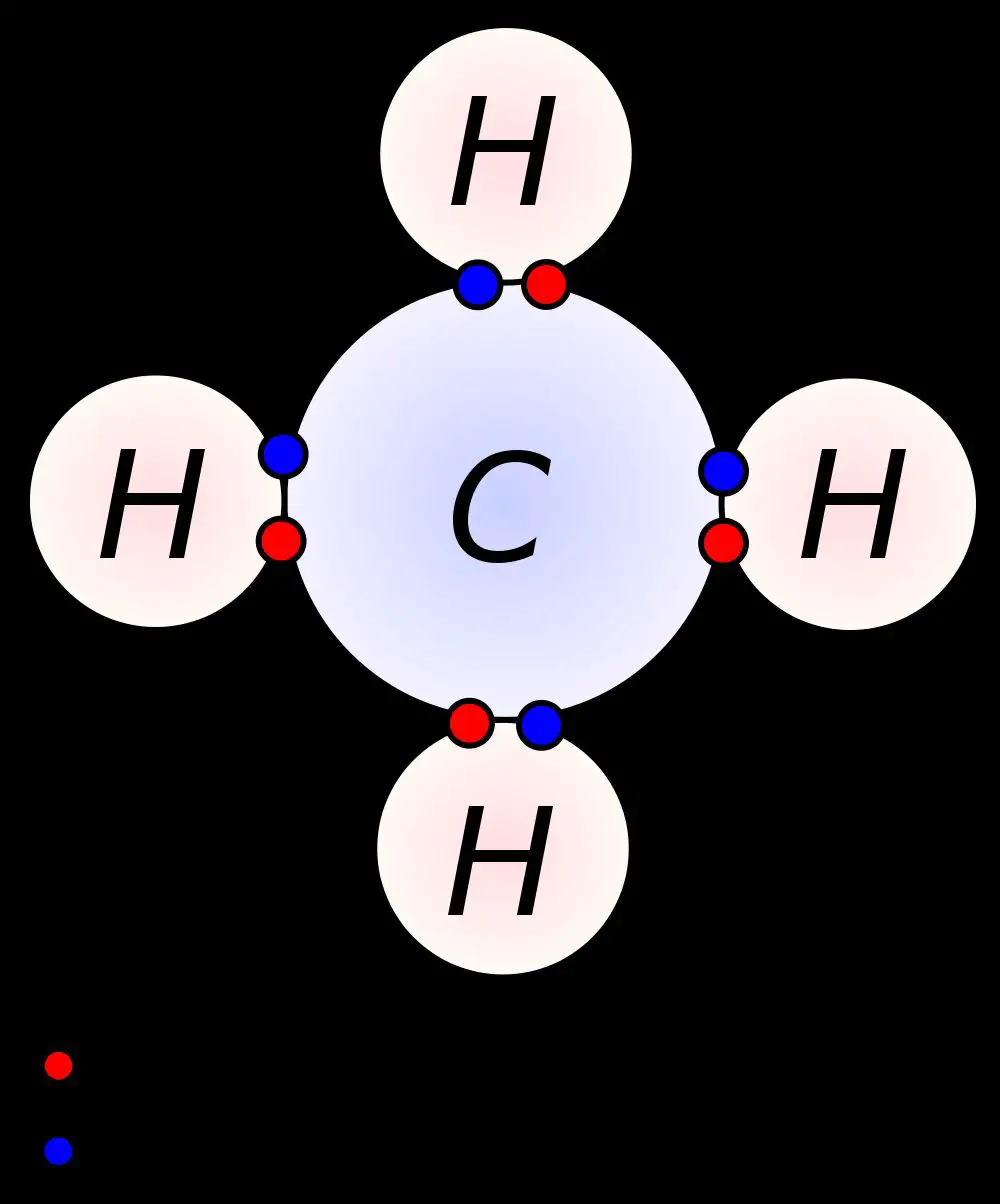
Kovalent bağ, söz konusu atomların dış yörüngelerinin dolması ile meydana gelir. Bu tür bağlar, moleküller arası hidrojen bağından daima daha güçlü, iyonik bağ ile ise ya aynı güçte ya da daha güçlüdür.
Bazı inorganik maddelerin -hidrojen, amonyak, klor, su ve azot molekülleri ile tüm organik maddelerin molekülleri kovalent bağ ile bir arada tutulmaktadır.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
Tarihçe
Kovalent bağ kavramı, ilk olarak 1916`da Gilbert N. Lewis tarafından, atomlar arasında elektron çiftlerinin paylaşılması şeklinde ortaya atılmıştır. Buna göre, dış yörüngedeki valans elektronları, atomik semboller etrafında birer nokta ile temsil edildiği Lewis notasyonu veya elektron nokta notasyonu ile gösterilmektedir. Atomlar arasındaki elektron çiftleri kovalent bağları göstermekte, çoklu çiftler ise çoklu bağlara karşı gelmektedir.Her ne kadar, paylaşılmış elektron çiftleri fikri, kovalent bağlanmanın etkin ve miktarsal tanımını yapıyor olsa da, bu bağların doğasını anlamak ve basit moleküllerin yapısını ve özelliklerini tahmin edebilmek için kuantum mekaniği bilgisine ihtiyaç vardır. Kimyasal bağlanmanın, kuantum mekaniği açısından ilk başarılı açıklamasını 1927`de Walter Heitler ve Fritz London yapmıştır.
Bağ polaritesi
İki tür kovalent bağ vardır: polar ve polar olmayan (veya saf). Saf kovalent bağlar (ki genellikle çözünür değildirler, elektrik iletkenlikleri yoktur ve bireysel molekül formundadırlar) ve iyonik bağlar (çözünürdürler, ergimiş ve çözünmüş haldeyken elektrik iletirler, ve genellikle kristal formundadırlar) spektrumun iki ucunda yer alırlar ve farklı özelliklere sahiptirler. Polar kovalent bağlar ise ortada yer alır ve her ikisinin de özelliklerini gösterirler.En son teori
Günümüzde valans bağ modeli, moleküler yörünge modeliyle desteklenmektedir. Bu modele göre, atomlar bir araya getirildikçe atomik yörüngeler, moleküler yörüngeler oluşturmak üzere etkileşirler. Kuantum mekaniği kullanılarak elektronik yapının, enerji seviyelerinin, bağ açılarının, ve bağ mesafelerinin yüksek bir hassasiyetle hesaplanması mümkündür.Kaynakça
- http://www.chemguide.co.uk/atoms/bonding/covalent.html
- http://www.chem.ox.ac.uk/vrchemistry/electronsandbonds/intro1.htm