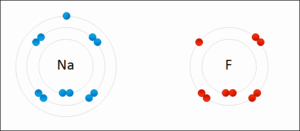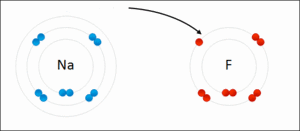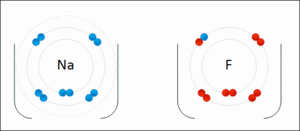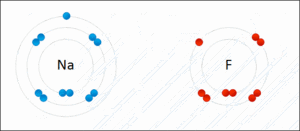
En dıştaki elektron kabukları tamamen dolu olan atomlar oldukça kararlı durumdadırlar, başka atomlarla bileşik oluşturma eğilimi göstermezler. Sadece soy gazların en dış elektron kabukları tamamen doludur, diğer tüm elementlerin dış kabuklarında eksik elektron bulunmaktadır. Oysa atom, tüm elektron kabuklarının dolu olması yönelimindedir ve eğer dolu değilse bunu sağlamaya yönelecektir. Bu konumda atomun başına iki farklı olay gelebilir, dış kabuktaki elektronlardan kurtularak zaten dolu olan bir alttaki kabuğu son kabuk haline getirmek ya da dış kabuğu dışarıdan elektron alarak tamamlamak.
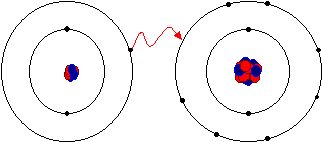
Elektron verme eğiliminde olan bir atomla dana ve almama olan elelk elektron alma eğilimindeki bir atom reaksiyon alanına girdiklerinde, aralarında bir elektron alış-verişi olur. Bunun sonucunda elektron alan atom negatif iyon (anyon), elektron veren atom ise pozitif iyon (katyon) haline gelecektir. Bu şekilde aralarında elektrostatik çekme kuvveti yaratılan atomlar iyonik bağla bir bileşik oluştururlar. İyon bağına elektro valans bağ da denilmektedir.
İyonik bağla oluşan bileşiklerin bir ortak özelliği, elektroliz edilebilmeleridir. Yani iyonik yapıdaki sıvı ve katı çözeltiler elektriği iletirler. İyonik yapılı katılar ise iletken değildirler. Bir diğer özellik de elektronların kuvvetle tutulması nedeniyle iyonik kristallerin ısıyı ve elektriği iletmemesi, diğer bir deyişle yalıtkan olmalarıdır.
İyonik bağ oluşumunda, metal, düşük elektronegatifliği nedeniyle bir elektron vererek pozitif bir iyon (katyon) oluşturur. Normal sofra tuzunda, sodyum ile klor iyonları birbirlerine iyonik bağ ile bağlıdır. İyonik bağ genellikle metallerle ametaller arasında gerçekleşir. Ametal atomlarının elektronegatifliği yüksektir ve kolayca elektron alıp negatif iyon (anyon) oluşturabilirler. Dolayısıyla, iki veya daha fazla iyon, elektrostatik kuvvetlerin etkisiyle birbirlerini çekerler. Bu tür bağlar, hidrojen bağından daha kuvvetli fakat kovalent bağ ile hemen hemen aynı kuvvettedir.
İyonik bağlanma yalnızca, bağlanmış atomlar serbest olanlardan daha düşük enerjiye sahip olduklarında ve reaksiyonun toplam enerji değişimi, reaksiyonun gerçekleşmesi yönünde ise meydana gelir. Toplam enerji değişimi ne kadar büyükse, bağ o kadar güçlüdür. Tüm iyonik bağlar bir tür kovalent ya da metalik bağ özelliği taşırlar. İki atom arasındaki elektronegatiflik farkı ne kadar büyükse bağ da o kadar iyoniktir. İyonik bileşikler, ergidiklerinde veya suda çözündüklerinde elektrik iletebilirler. Genellikle yüksek ergime sıcaklığına sahip olup suda çözünmeye meyillidirler.