}
}(abstract only). Not published in full until } Reprinted }
} (reprinted in his Papers, 3, 167, 183.)
} Waterston's key paper was written and submitted in 1845 to the Royal Society. After refusing to publish his work, the Society also refused to return his manuscript and stored it among its files. The manuscript was discovered in 1891 by Lord Rayleigh, who criticized the original reviewer for failing to recognize the significance of Waterston's work. Waterston managed to publish his ideas in 1851, and therefore has priority over Maxwell for enunciating the first version of the equipartition theorem. 1859'da James Clerk Maxwell bir gazın kinetik ısı enerjisinin çizgisel ve dönme enerjisine eişt olarak bölündüğünü öne sürdü.} Read by Prof. Maxwell at a Meeting of the British Association at Aberdeen on 21 September 1859. 1876'da Ludwig Boltzmann bu prensibi, bir sistemdeki ortalama enerjinin hareketin bütün bağımsız bileşenlerine eşit olarak bölüneceğini göstererek genişletti.} } In this preliminary work, Boltzmann showed that the average total kinetic energy equals the average total potential energy when a system is acted upon by external harmonic forces.} } Boltzman katıların özgül ısı kapasiteleri için Dulong†“Petit yasasının kuramsal açıklamasını sağlamak için eşbölüşüm teoremini kullandı. Eşbölüşüm teoreminin tarihi özgül ısı kapasitesininki ile iç içe geçmiştir. Her ikisi de 19. yüzyılda araştırıldı. 1819'da Fransız fizikçiler Pierre Louis Dulong ve Alexis Thíérí¨se Petit oda sıcaklığında katı elementlerin özgül ısı kapasitelerinin elementin atom ağırlığı ile ters orantılı olduğunun keşfettiler.} } Onların yasası yıllarca atom ağırlığının hesaplanması için bir teknik olarak kullanıldı.} Ancak James Dewar ve Heinrich Friedrich Weber'in takip eden araştırmaları Dulong†“Petit yasasının sadece yüksek sıcaklıklarda geçerli olduğunu gösterdi;}
} }
} } düşük sıcaklıklarda ve elmas gibi son derece sert katılarda özgül ısı kapasitesi daha düşüktü.} }
} } Read at l'Acadíémie des Sciences on 11 January 1841.
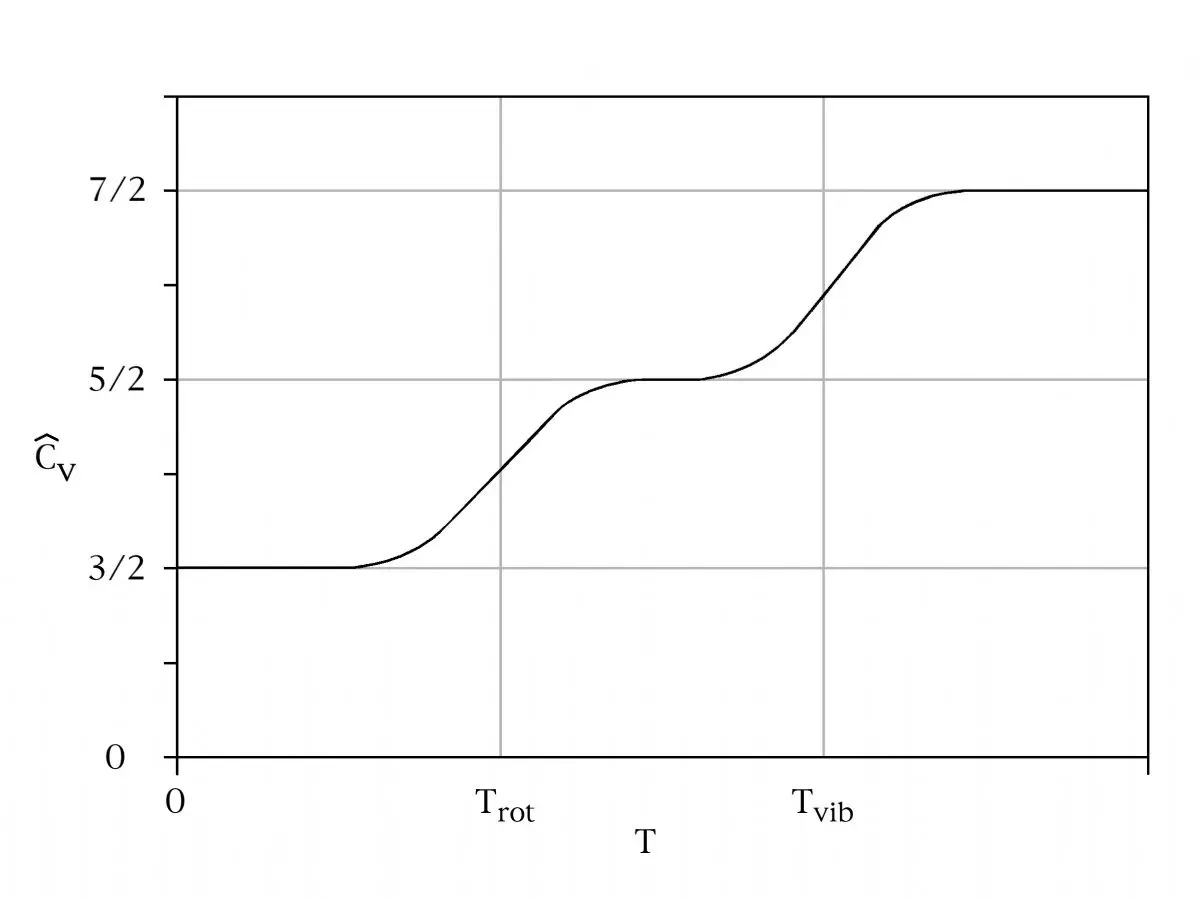
} } Gazlar için özgül ısı kapasitesi üzerine yapılan deneysel gözlemler de eşbölüşüm teoreminin geçerliliği hakkındaki endişeleri artırdı. Teorem molar ısı kapasitesinin basit tek atomlu gazlar için kabaca 3 cal/(mol·K) iken iki atomlu gazlar için 7 cal/(mol·K) olması gerktiğini öngörür. Deneyler eski tahmini doğruladı} } fakat iki atomlu gazlar için molar ısı kapasiteleri sıklıkla yaklaşık 5 cal/(mol·K) olarak bulundu, } } ve düşük sıcaklıklarda yaklaşık olarak 3 cal/(mol·K) değerine düşüyordu.} } Maxwell 1875'te deney ve eşbölüşüm arasındaki uyuşmazlığın bu sayıların gösterdiğinden daha kötü olduğuna işaret etti;} A lecture delivered by Prof. Maxwell at the Chemical Society on 18 February 1875. atomların iç kısımları var olduğu için ısı enerjisi bu iç kısımların hareketine gitmesi gerekir, bu da tek atomlu ve iki atomlu gazlar için öngörülen özgül ısı kapasitelerinin 3 cal/(mol·K) ve 7 cal/(mol·K) değerinden daha büyük yapar. Üçüncü bir çelişki metallerin özgül ısısıyla ilgilidir.} Klasik Drude modeline göre metal elektronları neredeyse ideal gaz gibi davranır, yani elektronlar ısı kapasitesine (3/2) NekB kadar katkıda bulunmalıdır. Buradaki Ne elektron sayısını verir. Ancak deneysel olarak elektronların ısı kapasitesine katkıları küçüktür: çoğu iletkenin ve yalıtkanın molar ısı kapasiteleri neredeyse aynıdır. Eşbölüşümün molar ısı kapasitesini açıklamaktaki başarısızlığı konusunda muhtelif açıklamalar getirildi. Boltzmann eşbölüşüm kuralının türetilişinin doğruluğunu savundu, ancak gazların esirle olan etkileşimlerinden dolayı termal dengede olamayabileceğini söyledi.} Lord Kelvin eşbölüşüm teoreminin deneylerle uyuşmadığı için doğru olmadığını öne sürdü ancak nasıl olduğunu göstermekte başarısız oldu.} Re-issued in 1987 by MIT Press as Kelvin's Baltimore Lectures and Modern Theoretical Physics: Historical and Philosophical Perspectives (Robert Kargon and Peter Achinstein, editors). ISBN 978-0262111171 Lord Rayleigh daha radikal bir görüş ile ortaya atıldı. Ona göre hem eşbölüşüm teoremi hem de termal dengenin deneysel varsayımı doğrudur. Bu ikisini uzlaştırmak için eşbölüşüm teoreminin yıkıcı basitliğinden kaçışı sağlayacak yeni bir prensibe ihtiyaç duyulduğunu belirtti.} Albert Einstein 1907'de kuantum etkisi sebebiyle olan bu özgül ısıdaki anormallikleri göstererek kaçışı buldu. == Uygulamaları İdeal gaz yasası } İdeal gazlar eşbölüşüm teoreminin önemli bir uygulamasını oluşturur. Parçacık başına ortalama kinetik enerji formülü: : olmak üzere, eşbölüşüm teoremi klasik mekanikten ideal gaz yasasının türetilmesinde kullanılır.} q = (qx, qy, qz) ve p = (px, py, pz) gazdaki bir parçacığın konum ve momentum vektörü ve F de parçacığa uygulanan net kuvvet olsun; : Buradaki, ilk denklem Newton'un ikinci yasasıdır ve ikinci sırada Hamilton denklemleri ve eşbölüşüm teoremii kullanılır. N parçacıklı bir sistem için, : formülü sağlanır. Newton'un üçüncü yasası ve ideal gaz varsayımı ile sisteme uygulanan net kuvvet kabın duvarlarının uyguladığı kuvvettir, ve bu kuvvet gazın P basıncı ile verilir. Dolayısıyla : sonucuna ulaşılır. Buradaki 'dS'' kabın duvarları boyunca sonsuz küçük alan elemanıdır. Konum vektörünün diverjansı q', : olduğundan diverjans teoremi : olarak ifade edilir. Buradaki dV kab içindeki sonsuz küçük hacim elemanı ve V kabın toplam hacmidir. Bu eşitliklerin bir araya getirlimesiyle : elde edilir. Bu da N parçacık için ideal gaz yasasını ifade eder: : Buradaki n = N/NA mol sayısı ve R = NAkB de gaz sabitidir. Eşbölüşüm ideal gaz yasası ve iç enerjinin türetilmesini bastitçe sağlıyor olsa da aynı sonuç alternatif bir yöntem olan bölüşüm fonksiyonunun kulanılmasıyla da elde edilebilir.L. Vu-Quoc, Configuration integral (statistical mechanics), 2008.