Hidrojen Peroksit
Kısaca: Alm. Wesserstoff peroxyd (n), Fr. Peroxyde (m) d'hydrogene, İng. Hydrogen peroxide. Formülü H2O2 olan ve kimyâsal olarak kararlı olmayan yoğun bir sıvı. ...devamı ☟
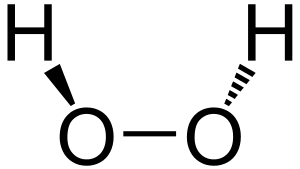
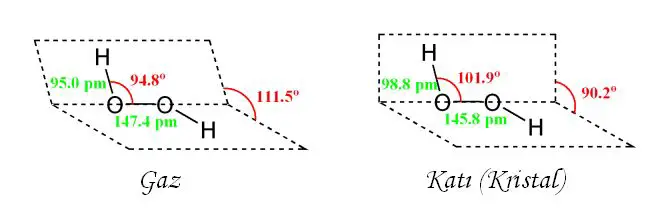
Özellikleri: Hidrojen peroksit, renksiz ve kokusuz bir sıvı olup, suda bol miktarda çözünür. Alkolde de çözünür. Kolaylıkla su ve oksijen vermek üzere bozunur. Saf hidrojen peroksit 1 atmosfer basınçta -0,43°C'de donar ve 150,2°C'de kaynar. Sıvı halde ve 255°C'de yoğunluğu 1,44 g/cm3tür. % 90'lık hidrojen peroksit çözeltisi patlayıcı olmamakla beraber % 75'ten % 90'lığa kadar H2O2 ihtiva eden çözeltiler patlayabilir.
Saf hidrojen peroksit yavaşca bozunur. Mesela metal gibi az bir safsızlık bozulmanın hızını artırır. Burada metal safsızlığı katalitik etki yapmaktadır. Bozunması, saflaştırma ve bazı kararlılık veren mesela 8-hidroksikkinolin, sodyum piro fosfat ve alkali metal silikat gibi maddeler ile durdurulabilir. Bozunmada en güçlü katalizör kolloidal plantindir.
Hidrojen peroksit ortama bağlı olarak indirgen ve yükseltgen özelliğe sahiptir.
Bulunuşu: Hidrojen peroksit tabiatta kar ve yağmur içerisinde eser miktarda bulunmaktadır. Suyun elektrolizi esnasında katot çevresinde meydana gelir.
Elde edilişi: 1. Baryum oksidin havada 500°C'ye ısıtılması ile elde edilen baryum peroksidin sülfat asidi ile muamelesinden elde edilir ki bu en eski metoddur.
BaO2 + H2SO4 ® BaSO4 + H2O2
derişik sülfat asidi elektroliz edildiğinde peroksidisülfat asidi elde edilir. Bunun su ile reaksiyonundan hidrojen peroksit elde edilir:
H2S2O8 + 2H2O ® 2H2SO4 + H2O2
2. Etil antrakinonun otoksidasyonundan da elde edilir.
Kullanılışı: Hidrojen peroksidin çok yaygın kullanılışı vardır. % 3'lük çözeltisi mikrop öldürücü olarak kullanılır ve buna halk arasında oksijenli su denir. % 3-6'lık çözeltisi saçları sarartmakta kullanılır. % 30'luk çözeltisine perhidrol denir ve kimya laboratuvarlarında, elektronik sanayiinde kullanılır. % 30-50 arasındaki konsantrasyonlar tekstil sanayiinde pamuklu kumaşları beyazlatmak maksadıyla kullanılır. Kumaştaki renk bozukluğunu elyafın kalitesini bozmadan gidererek etkili bir şekilde beyazlatır. Elde edilen beyazlık fevkalade ve kalıcıdır. Aynı çözelti, kağıt hamurunu, ahşap yüzeylerini, yün, ipek, yağ ve bazı yiyecekleri beyazlatmak için de kullanılır. % 70'lik çözeltisi geniş miktarda organik maddeleri ve anorganik iyonları oksitlemede kullanılır.Derişik hidrojen peroksit deriyi tahriş edicidir.
hidrojen peroksit Resimleri

Hidrojen peroksit
3 yıl önceHidrojen peroksit (H2O2) soluk mavi renkte; sulandırıldığında ise renksiz hale gelen bir bileşiktir. Hidrojen peroksitin akmazlık değeri, sudan daha yüksektir...
Peroksit
3 yıl önceiyonlarının aksine, peroksit iyonundaki oksijen atomları -1 yükseltgenme seviyesine sahiptir. En yaygın peroksit olan hidrojen peroksit (H2O2), konuşma dilinde...
Oksit, Kimya, Azor, Sodyum peroksit, MahnezyumAseton peroksit
3 yıl öncekimyasal kullanılmıştır. Beyaz renkli kristalize yapıdadır. Aseton ve hidrojen peroksit tepkimesi ile elde edilir. Nötr ortamda monomer; asidik ortamda dimer...
Sırt roketi
7 yıl öncekullanmaya başlanmıştır. Yakıt olarak da Hidrojen peroksit (H2O2) kullanmıştır. Geliştirilen sistem ikisi hidrojen peroksit biri de azot olan üç tüpten oluşmaktadır...
Substrat
3 yıl öncealmaktadır. Aşağıdaki denklemde, katalaz enziminin substratı olan hidrojen peroksit, reaksiyon sonucu su ve oksijene ayrışmaktadır; 2 H2O2 → 2 H2O + O2...
Gliseraldehit
3 yıl önceyanma aracılığıyla hazırlanabilmektedir. Bunun için katalizör olarak hidrojen peroksit ve demir tuzu kullanılmaktadır. Stereoizomerlik Merck Index, 11th...
Aseton
3 yıl öncehidrojen peroksit gibi oksitleyicilerle oksitlenmesi sonucu çok güçlü bir patlayıcı olan aseton peroksit oluşur. Kazara aseton ile hidrojen peroksit karıştırıldığında...
Aseton, Bakır, Baz, Etanol, Gaz, Katalizör, Kaynama noktası, Keton, Kimya, Kırmızı, SuSodyum
3 yıl öncevererek su etkisi ile ayrışır (Bk.Oksilit) ve asitlerle oksijenli su (Hidrojen peroksit) verir. Sodyum hidroksit veya kostik soda (sud kostik) NaOH 320 °C’te...
Sodyum, 1807, Aktinyum, Alaşım, Alkali metaller, Altın, Alüminyum, Amerikyum, Ametal, Antimon, Argon
misafir - 9 yıl önce
misafir - 9 yıl önce
misafir - 9 yıl önce
misafir - 9 yıl önce