Enzimler, canlı hücrelerce genlerin kontrolünde meydana getirilirler. Enzimlerin yokluğunda, birçok canlının hayatiyeti için önemli olan reaksiyonlar, bazan hızı ölçülemeyecek kadar yavaş seyreder. Enzimlerin varlığı, reaksiyonların hızını milyarlarca kere arttırabilir. Enzimler reaksiyonların dengesini bozmaz. Sadece hızına tesir eder. Yaşayan her canlı hücre, bağımsız olsun veya bir dokunun parçası olsun, varlığı ve üremesi için gerekli yüzlerce çeşit enzim ihtiva eder. Bazı enzimler hücre içindeki alt yapılarda üretilip, hücre içinde vazife görürken, bazıları da hücreden vücut sıvılarına ve boşluklarına (kan, sindirim sistemi gibi) salgılanırlar.
Her enzim çok özel kimyasal reaksiyonları katalizlemek üzere vücuttaki hücreler tarafından yapılmaktadır. Enzimlerin hormon denilen biyokimyasal maddelerce kontrolü ve kendilerine verilen bu çok özel görevler organizmanın işleyişinde birinci sırada önemi haizdir.
Tarihçesi: Enzimler ilk olarak 19. yüzyılın başlarında, Fransız ve Alman kimyacılar tarafından tanımlanmıştır. Bu araştırmacılar daha çok şekerin mayalanması üzerinde çalışmışlardır. 1860’ta Pasteur mayalanmanın maya hücresi tarafından yapıldığını ileri sürdü. Enzimlerin protein tabiatında olduğu 1930’larda gösterildi. Daha sonraları çeşitli enzimler kristal şeklinde elde edilip tanımlandı. 1960’larda enzimlerin yapıları, amino asit dizileri tayin edilmeye başlandı. Biyokimyasal genetik alanındaki araştırmaların çoğu enzimlerin yapımı ve genetik kontrolünü incelemektedir.
Yapısı: Enzimler büyük proteinlerdir. Bu protein zincirleri çeşitli bükülme ve düğümlenmeler yaparak vazife görebilecekleri şekillere girerler. Meydana gelen üç buutlu karışık yapı, çok hassastır. Zincirin hiçbir kimyasal bağı rastgele değildir. Bir enzimin bu özel yapısı (düğümlü ve kıvrımlı) kuvvetli asit ve alkalitlerle, sıcakla bozulabilir. 55 oC’nin üzerinde enzimler, genellikle çalışamazlar (yani bu sıcaklıkların üzerinde pıhtılaşarak hayatiyetlerini kaybederler). Yapının bozulması ile protein çözülür ve enzim vazife görme kabiliyetini kaybeder.
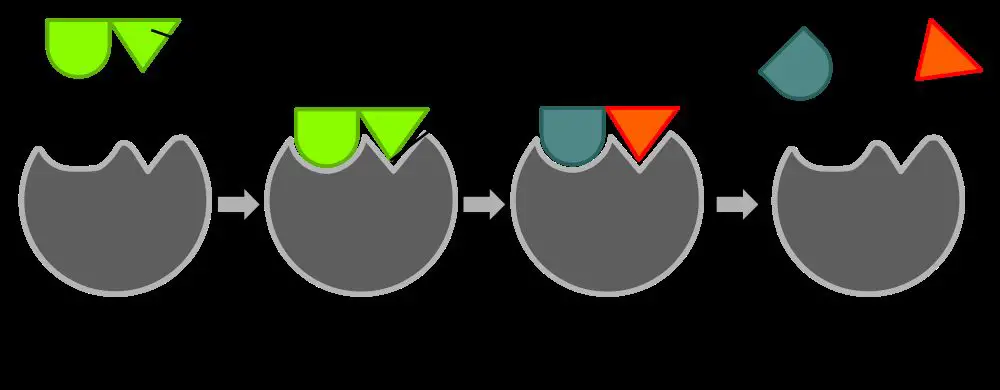
Enzimin karmaşık yapısı üzerinde anahtar bölgeler mevcuttur. Bu bölgelere aktif vazife gören bölge denir. Enzimin reaksiyona soktuğu maddeye, “substrat” denir. Katalizin meydana gelmesi için, substratın anahtar bölgeye uyan kısmının buraya yerleşmesi gerekir. Bu yerleşme için substrat molekülü ve anahtar bölge arasında molekül seviyesinde adeta bir kilit ve anahtar gibi uyum şarttır. Bu uyumun sağlanmasında moleküllerin elektrostatik yükleri, suda çözünebilme özellikleri önemlidir.
Enzimler tek bir protein zincirinden veya bir kaç zincirin birleşmesinden meydana gelir. Enzimler protein olmakla birlikte birçoğu protein olmayan, fakat kataliz için gerekli yapıları ihtiva ederler. Bu durumda enzimin protein kısmına apoenzim, diğer kısmına ise koenzim denir. Koenzim; bazan demir, bakır, mağnezyum, çinko gibi bir metal iyonu, bazan da amino asit olmayan organik bir maddedir. Organik koenzimler olarak bilinen maddeler, yapılarında vitaminleri veya mikroorganizmalar için büyüme faktörü olan maddeleri ihtiva ederler. NAD,FAD ve bazı Bvitamini kompleksleri böyledir.
Enzimlerin yaptığı işin en önemli hususiyeti çok özel olmasıdır. Bunu enzim proteininin sahib olduğu zincirin bükülme, düğümlenmelerinden meydana gelen üç buutlu yapısı sağlar. Burada özel kelimesi ile kast edilen enzimin sadece tek bir kimyasal reaksiyonu katalizlemek üzere yapılmış olmasıdır. Yani her enzim türü belli bir reaksiyonu yönetir. Enzimlerin bu hallerine “spesifik özellik” denir.
Enzim ve substrat arasındaki bu hassas ilişkinin sağlanması için, enzimin substratını, benzer yapıdaki diğer maddeler arasından seçebilme kabiliyetinin olması gerekir. Yani enzimler kendi substratlarını çok iyi tanırlar ve bu tanıma işi oldukça hassastır. Mesela aynı özellikteki bir bağı parçalayan birden fazla enzim bağı meydana getiren amino asit moleküllerini tanıyarak vazife görürler. Yine pankreasta yapılan tripsin enzimi sadece arginin veya lizin amino asidinin yaptığı bağları yıkar. Pankreasta yapılan kimotripsin ise, tripsinin etki ettiği yere etki etmez. Fakat fenilalanin gibi suda çözünmeyen amino asit birimlerine karşı etkilidir. Demek ki vücutta her vazife için ayrı bir enzim yapan hassas bir düzen mevcuttur. Enzimler karbon atomlarının üç buutlu yerleşim şekillerini bile ayırt ederler. Bu aşırı seçicilik enzim ve substrat arasındaki çeşitli bağlar sayesinde meydana gelir. Enzimdeki bağların meydana getirdiği karışık yapı enzime ayrı bir hassasiyet sağlar.
Enzimler genellikle üzerine etki ettiği maddenin isminin sonuna-ase (az) getirilerek adlandırılır. Mesela; Sukroz’a etki eden enzimin adı sukrase (sukraz)’dır. Enzimler çoğunlukla renksizdir. Ama sarı, yeşil, mavi ve kırmızı olabilirler. Enzimlerin çoğu suda çözülebilir ama bazıları yağlı proteinlerle bağlı olduklarından çözünmezler. Bazı enzimlerin katalitik kabiliyeti çok üstündür. Mesela sığır karaciğerinden elde edilen ve demir taşıyan bir kataloz enzimi molekülü, 5.000.000 hidrojen peroksit molekülünü 0oC’de ve bir dakikada bileşenlerine ayırır. Kataloz enzimi yan ürün olarak çıkan hidrojen peroksiti yok ederek hücreyi korur. Çoğu enzimler basit olarak hücrenin stoplazmasına dağılmışlardır. Diğer enzimler ise belli hücre yapılarına sıkıca yapışıktır, elde edilmeleri zordur.
Enzim faaliyetlerinin düzenlenmesi: Enzimlerin faaliyeti çeşitli yollardan kontrol edilir. Bazı mekanizmalar enzim yapımını kontrol eden genler vasıtasıyla, bazıları da katalitik reaksiyonu etkileyerek olur.
Enzimin faaliyetindeki temel nokta, enzim ve substrat arasındaki özel bağlanmadır. Enzimin anahtar bölgesine başka maddeler de bağlanıp substratla yarışa girebilirler. Bu tip yabancı maddelerde enzimin faaliyetini sağlayan bağlar yoktur. Böylece enzimlerin faaliyetini engeller. Bu tip engellemeye “kompetitif inhibisyon” denir ve mevcut substratın miktarını arttırarak önlenebilir. Enzimin faaliyetini engelleyen diğer bazı maddeler ise substrat miktarını arttırmak ile önlenemeyen bir engelleme yaparlar. Buna “nonkompetitif inhibisyon” denir. Aktivatör denilen bazı kimyasal maddeler enzimlerin faaliyetlerini arttırırlar. Bu maddeler enzim üzerindeki engelleyici bir maddenin (mesela bakır, civa, kurşun gibi bazı ağır metallerin)yerini değiştirerek vazife görürler.
Enzim faaliyetinin Özellikle hücre içindeki enzim sistemlerindeki kontrolünün özel bir önemi vardır. Allosterik etkileyiciler olarak bilinen bazı maddeler birden fazla zincirden meydana gelen enzimlerin yapılarını değiştirerek etki ederler. Bunlar bazan bir metabolik yolda subap vazifesi görerek üretilen madde miktarını kontrol ederler. Vücuttaki metabolik sistemlerde bunun çok örneği görülebilir. İzah edilecek olursa, hücre içinde belli bir maddenin yapımı için gerekli birçok olayları ihtiva eden metabolik yollar mevcuttur. Bu yollarda çeşitli ara ürünler yapılır. Hücreler ihtiyacı olan maddeleri gerektiği kadar sentezleyen ekonomik birimler olduğu için, metabolik yollarda bu kaideye uyar. Metabolik yoldaki son ürünün miktarı ara ürünler (allosterik etkileyiciler)tarafından devamlı kontrol edilirler. Ürün yeterli ise ara ürünler enzimi engelliyerek yapımı durdururlar.
Enzimlerin faaliyetini arttırmak veya baskılamak mümkündür. Enzim kontrolündeki yollardan birisi olan bu özellik enzimlerin sadece ihtiyaç olduğu zaman yapılmalarını mümkün kılar.
Metabolizmada enzimler: Sindirim ve besinlerin yakımı büyük ölçüde enzimler vasıtasıyla olur. Memelilerde nişastanın yıkımı (parçalanışı) salya ve pankreastan salınan amilaz ile olur. Diyetteki yağlar pankreastaki lipaz’la yıkılır. Proteinlerin yıkımı daha karışıktır. Midede pepsinle başlar, ince barsakta tripsin ve kimotripsin ile devam eder. Barsak duvarında yapılan bazı enzimler de proteinlerin sindiriminde rol alır. Yıkılan maddeler asetil koenzim-A denen bileşiğe çevrilir. Bu madde de hücrede su ve karbondioksite yıkılır. Yıkımda bir dizi solunum enzimleri rol alır. Diğer yandan da organizma için lüzumlu enerji maddeleri elde edilir.
Enzimler hücre için gerekli maddelerin, hormonların sentezinde de temel bir rol alırlar. Bazı ilaçlar enzimlerin işleyişini etkilerler. Tabii antibiyotikler ise bakterilerin büyümesi için gerekli enzimleri engelleyerek mikropları öldürürler. Böcek öldürücü olarak kullanılan çeşitli organik fosfatlar da insanda sinirlerdeki bazı enzimleri etkileyerek felç yaparlar.
Enzimlerin eksikliği veya fazlalığı insanlarda çeşitli hastalıklara yol açar. Bunların çoğu irsi hastalıklardır, teşhisi kandaki enzim miktarları tayin edilerek yapılır. Enzimlerin tedavide kullanımı oldukça sınırlıdır.
Enzimler etkilerine göre başlıca üç gruba ayrılırlar:
1.Hidrolazlar:Hidroliz yapan enzimlerdir. Su almak veya su vermek suretiyle muhtelif bağları parçalar veya sentez eder. (Karbonhidrozlar, esterazlar, proteazlar).
2. Dehihidrogenazlar:Bileşiklerden hidrojen ayıran enzimlerdir.
3. Desmolazlar:Bileşiklerinde iki karbon atomu arasındaki bağı parçalar.
Enzim konusundaki son gelişmeler: Bazı araştırıcılar, enzimlerin aminoasit dizisini değiştirmeye çalışmaktadırlar. Bunların gayesi daha etkili enzimler elde etmektir. Yapılan genetik çalışmalar yakın bir gelecekte enzim dayanıklılığının artırılmasını planlamaktadır. Son kırk yılda bakterilerden elde edilen Penisilin miktarı bu metotlarla 10.000 kat arttırılabildi. Sonuçlar henüz açıklanmamakta, fakat şimdiye kadarki çalışmalar bir rüya gibi gelen enzimleri değiştirme fikrinin geçerli olduğunu göstermiştir.
Son yılların önemli keşiflerinden birisi de “restriksiyon enzimleri”dir. Bu enzimler gen mühendisliğinde kalıtım bilgilerini taşıyan DNAmaddesini kesmek için kullanılır. Bakteriler, virüslerin saldırılarından korunmak için bu enzimleri yapmaktadırlar. Bakteri, virüsün deoksiribonükleik asidini, (DNA’yı) bölerek virüsü nötralize eder veya sınırlar. Şimdiye kadar 350’den fazla restriksiyon enzimi bulunmuştur. Bu enzimlerin her biri belli aralıklarla daima aynı bölgeden olmak üzere DNA’yı keserler. Moleküller biyologlar bu enzimleri kullanarak DNA’nın (genlerin) haritasını çıkarırlar. Kesilen DNA parçalarının uçları yapışkandır, başka bir DNAparçasına yapışabilir. Böylece bu çok önemli özellik sayesinde değişik bilgiler ihtiva eden, yeni genetik maddeler başka bakterilere aktarılabilmektedir. Değişik özellikler kazanan bu bakterilerin istenilen proteinleri yapmaları sağlanmaktadır. Bu metotla laboratuvarda elde edilemeyen çeşitli hormonlar (büyüme hormonu, insülün vs.)ucuz ve çok miktarda elde edilmiştir.
Kaynak: Rehber Ansiklopedisi
Enzimler, Proteinlerden yapılmışlardır ve doğal olarak yalnız canlılar tarafından sentezlenirler. Hücre içerisinde meydana gelen binlerce tepkimenin hızını ve özgüllüğünü düzenlerler. Çok defa hücre dışında da etkinliklerini korurlar. Solunumun, büyümenin, kas kasılmasının, sinirdeki iletimin, fotosentezin, azot bağlanmasının, deaminasiyonun, sindirim vs.nin temelini oluştururlar.
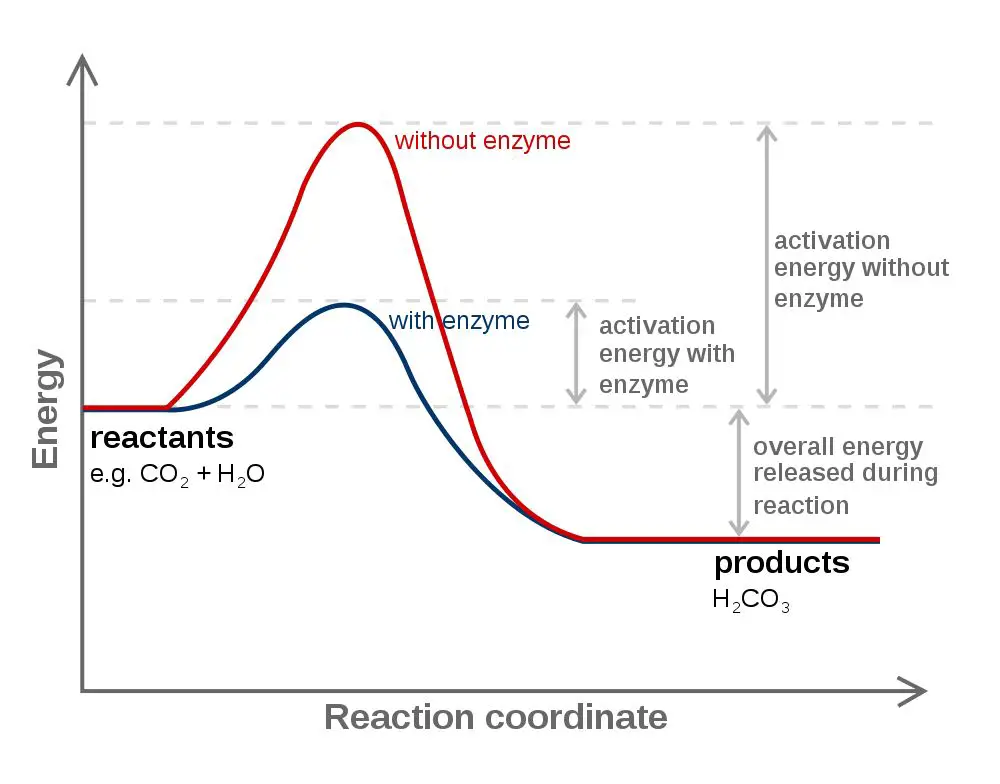
Canlı hücrelerde tepkimeler kural olarak 0-50°C; çoğunlukla da 20-42°C arasında meydana gelir. Bu sıcaklıkta tepkimelerin oluşması biyokatalizör denen enzim ya da fermentlerle olur. Bu, aktivasyon enerjisinin düşürülmesi ile olur.
Başlangıçta "E n z i m" terimi, sindirim kanalında olduğu gibi bir çözelti ya da sıvı içerisinde etki ettiği durumlarda (Kühn 1878); buna karşın "Ferment = Maya" terimi çoğunluk hamur mayasında olduğu gibi, hücreye bağlı olduğu durumlarda kullanılmıştır. Buchner (1897), fermentlerin de hücre dışında etki ettiğini bulunca iki terim arasındaki farklılık ortadan kalkmış oldu. Her iki terim arasında bugün herhangi bir fark olmamakla beraber, bakteri, mantar ve diğer hücreli enzimatik işlevler, mayalanma ve etki maddeleri de ferment olarak kullanılacaktır.
Enzimlerin özellikleri
Yalıtılan enzimlerin tümü protein yapısındadır ya da protein kısmı bulundururlar. Etki ettiği maddenin sonuna "Ase = Az" eki getirilerek ya da katalizlediği tepkimenin çeşidine göre adlandırılırlar. Örneğin, kitine etki eden kitinaz enzimi vs. Çok defa renksizdirler, bazen sarı, yeşil, mavi, kahverengi ya da kırmızı olabilirler. Suda ya da sulandırılmış tuz çözeltisinde çözülebilirler. Fakat mitokondrilerde bulunan enzimler lipoproteinler ile bağlandığından (bir fosfolipit-protein kompleksi) suda çözünmez. Enzimlerin etkinlikleri akıllara durgunluk verecek derecededir; örneğin, sığır karaciğerinden elde edilen ve bir molekül demir içeren katalaz enzimi, bir dakikada, O C°'de 5.000.000 hidrojen peroksit (H2Cy molekülünü H2O ve 1 /2 O2'ye parçalayabilir. Enzimin etki ettiği bileşiğe "Substrat" denir; bu durumda hidrojen peroksit katalazın substratıdır. Enzimin saniyede etki ettiği substrat molekül sayışma Enzimin Etkinlik Değeri = Turnover Sayışı denir. Bu O C°'de katalaz enzimi için 5.000.000 dür. Bazı enzimler tepkimelerde yan ürün olarak vücutta H2O2 meydana getirdiğinden ve bu da vücut için zehirli olduğundan, katalaz enzimi onları sürekli parçalayarak hücreleri korur. Bir molekül katalaz enziminin parçaladığı H2O2'i demir atomu yalnız başına ancak 300 senede parçalayabilir. Ya da mol başına aktivasyon enerjisi için 18.000 kalori vermek gerekir. Kolloyidal platin bu aktivasyon enerjisini 11.700 Kal./Mol.'a, katalaz enzimi de 5500 Kal./Mol.'a düşürür. Bazı enzimler çok özgüldür; yalnız bir substrata etki eder. örneğin, üreaz yalnız üreye etki ederek onu amonyak ve CO2'de parçalar. Halbuki bazıları çeşitli substratlara etki eder; dolayısıyla daha az özgüldürler, örneğin peroksidaz başta hidrojen peroksit olmak üzere birçok bileşiğe etki eder. Bazı enzimler yalnız bazı bağlar için özgüldür, örneğin pankreastan salgılanan lipaz, yağlardaki ester bağlarına etki eder.
Kuramsal olarak enzimli tepkimeler dönüşlüdür; enzim, tepkimenin yönünü değil dengenin oranım saptar. Tipik örnek, lipazın yağı parçalaması; fakat aynı zamanda gliserin ile yağ asitlerini birleştirmesidir. Ortamda sadece yağ asidi ya da sadece gliserin ile yağ asitlerinin birleşimi varsa denge ona göre,
Yağ -------> gliserin + 3 yağ asidi şeklinde olur. Denge noktası, yani tepkimenin hangi yöne gideceği termodinamik yasalarına göre belirlenir. Çünkü denge bir tarata doğru giderken enerji verir, tersine enerji alır.
Enerjiye gereksinim gösteren tepkimelerin, enerji meydana getiren tepkimelerle aynı zamanda meydana gelmesi gerekir ya da enerji herhangi bir şekilde önceden depo edilmelidir. Canlı bünyesinde enerji depo etme, fosfor esterleri şeklinde olur. Yaşamsal işlevlerin yürütülmesinde ATP (adenozin trifosfat) en önemlilerindendir; bu bileşik batarya gibi görev yapar.
Enzimler hücrede bir takım 'team' halinde çalışır; birinin son ürünü kendisinden sonraki enzimin substratını yapar, örneğin, amilaz enzimi nişastayı iki zincirli maltoza, maltaz enzimi ise maltozu tek zincirli glikoza çevirir. Bir seri enzim aracılığıyla (11 kadar), daha sonra göreceğimiz gibi, glikoz da laktik aside çevrilir vs.
Enzimlerin Yapısı
Tüm enzim proteinleri genler tarafından şifrelenir. Dolayısıyla amino asit dizilimi kendine özgüdür (bir gen-bir enzim kuralını hatırlayınız). Bazı enzimler (pepsin ve üreaz gibi) yalnız proteinden oluşmuştur. Fakat diğer çoğunluğu iki farklı kısımdan meydana gelmiştir. Bunlar:
a) Protein Kısmı (enzimin Apoenzim kısmı): Bu kısım enzimin hangi maddeye etki edeceğini saptar.
b) Koenzim Kısmı: Organik ya da inorganik, çok defa fosfattan meydana gelmiş, protein kısmına göre çok daha küçük moleküllü bir kısmıdır. Enzimde işlev gören ve esas iş yapan kısım bu kısımdır. Koenzim kısmı genellikle protein kısmından ayrılabilir ve analizlerinde birçok vitamini bünyesinde bulundurduğu (thiamin, niacin, riboflavin vs.) görülmüştür. Buradan şu genelleştirmeyi yapabiliriz: Bütün vitaminler hücrede enzimlerin koenzim kısmı olarak ödev görürler. Ne koenzim ne de apoenzim kısmı yalnız başına etkindir. Bazı enzimler ortama yalnız belirli iyonlar eklendiğinde etkindirler, örneğin bazı enzim zincirine ancak Mg++ iyonu eklenince glikozu laktik aside çevirebilir. Tükürükteki amilaz nişastayı yalnız Cl iyonlarının bulunduğu ortamda parçalayabilir. Canlı bünyesinde bulunan eser elementler, Mn, Cu, Zn, Fe ve diğer elementler bu enzimatik işlevlerde aktivatör olarak kullanılır. Bazen enzimin iş görebilmesi için bir metal iyonuna gereksinim vardır. Yani koenzim kısmı metal iyonu ise (Ca++, K++ Mg+, Zn++) buna "Kofaktör" denir. Enzimin etkinlik göstermesi için gereksinme duyduğu organik moleküllere "K o e n z i m" denir. Bazı durumlarda koenzim kısmı apoenzim kısmına kuvvetlice (kovalent) bağlanmıştır; bu sıkı bağlanan kısma "Prostetik Grup"; prostetik grupla apoenzim kısmının her ikisine birden de "Holoenzim" denir. Koenzimlerden önemli olanların bazılarını hücre metabolizmasında göreceğiz.
Enzimlerin bir kısmı sitoplazmaya serbestçe dağılmış olarak, diğer bir kısmı da hücredeki bazı yapılara sıkıca bağlanmış olarak bulunur. Laktik asit, amino asit ve yağ asitlerinden türeyen maddeleri karbondioksit ve suya kadar parçalayan solunum enzimleri, mitokondri zarlarının yapışma katılır. Keza ribozomların işlevsel bütünlüğüne katılan enzimler de bu tiptir. Dokulardaki enzimler değişik yöntemlerle saptanabilir.
Enzimlerin Sınıflandırılması
Her enzimin 4 rakamlı bir numarası vardır, örneğin, 3.6.1.3. "ATP fosfohidrolaz" da birinci numara sınıfını, ikinci numara alt sınıfını, üçüncü numara grubunu, dördüncü numara da kendine özgü sıra numarasını) verir. Buna göre enzim sınıfları şunlardır:
1. Oksidoredüktazlar: Redoks tepkimelerini katalizler.
a) Dehidrogenazlar: Elektron kazandırıcı tepkimeleri etkilerler.
b) Oksidazlar: Elektron kaybeden tepkimeleri etkilerler.
c) Redüktazlar: Substratı bir redüktör aracılığıyla indirgeyen enzimlere denir. örneğin asetaldehit redüktaz, asetaldehiti alkole redükler.
d) Transhidrogenazlar: Bir molekülden diğerine hidrojen taşıyarak onu redüklerler.
e) Hidroksilazlar: Substratlarına bir hidroksil ya da su molekülü katan enzimlere denir, örneğin, fenilalanin hidroksilaz bir hidroksil grubunu fenilalanine ekleyerek onu tirozine dönüştürür.
2. Transferaz Enzimler: Hidrojenin dışında bir atomun veya atom grubunun (metil, karboksil, glikozil, amino, fosfat grupları) bir molekülden diğerine aktarılmasını sağlarlar.
Dekarboksilazlar: Karboksilik asitlerden CO2 çıkmasını sağlarlar.
3. Hidrolaz Enzimler: Bir molekül su sokmak suretiyle ya da su molekülü aracılığıyla moleküllerin yıkılmasını sağlayan enzimlerdir. Ester, peptit, asitanhidrit ve glikozidik bağlarına etki ederler.
a) Esterazlar: Ester bağım yıkan enzimlerdir (lipaz, ribonükleaz, fosfataz, pirofosfataz, glikozidaz).
b) Proteazlar: Peptit bağım yıkan enzimlerdir (proteinaz).
4. Liazlar: Su molekülü çıkarmadan molekülleri yıkan enzimlerdir, örneğin C-C bağı, aldolaz ve dekarboksilazla yıkılır. Keza C-0 ve C-N bağım yıkanlar da vardır.
5. İzomerazlar: Molekül içinde değişiklik yaparak onun uzayda dizilişin! değiştiren enzimlerdir. Örneğin razemaz, epimeraz.
6. Ligazlar (Sentetazlar): Enerji kullanarak substrat moleküllerinin birbirine bağlanmasını; örneğin amino asitlerin ve yağ asitlerinin aktifleşmesini sağlarlar.
Enzimlerin Çalışma Mekanizması
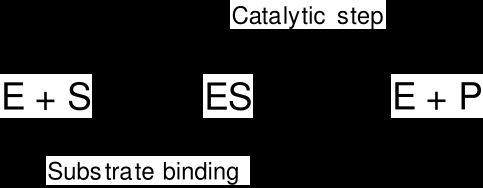
Daha önce de değindiğimiz gibi enzimin hangi substratla çalışılacağını saptayan kısmı apoenzim kısmıdır. Demek ki apoenzim kısmıyla substrat arasında bir ilişki vardır. Alman kimyacısı EMIL FISCHER tarafından bunun kilit anahtar uyumu gibi olacağı savunulmuştur. Koenzim kısmı daha çok kimyasal bağa yakın olarak işlev gösterir, örneğin ester bağlarını parçalar vs. öyle anlaşılıyor ki enzimin apoenzim kısmı bir ya da birkaç yerinden (aktif bölgelerden) substrat molekülüne yapışıyor ya da bağlanıyor (yani bir enzim-substrat kompleksi oluşturuyor) ve bu arada koenzim kısmı substrat üzerindeki bağlarla gerçek anlamda birleşmeye veya bağlanmaya giderek onu parçalıyor. Elinde kazması olan bir yol işçisi, kazacağı yeri kendisi saptamasına karşın (apoenzim kısmı), kazma işlemini yapan kazmanın kendisidir (koenzim kısmı). Enzimlerde kural aynıdır. Enzimlerin kimyasal yapıları, özellikle üçüncül yapıları tam olarak bilinmediğinden (ilk yapışı açıklanan enzim ribonükleaz, 124 amino asitten meydana gelmiştir) çalışma mekanizmaları da hala tam anlamıyla açıklığa kavuşturulamamıştır.
Enzimlerin Çalışmasına Etki Eden Faktörler : Sıcaklık
Sıcaklık 10 °C yükseldiğinde tepkime hızı iki misli artar; yani tepkime hızının yükselmesi, sıcaklıkla doğru orantılıdır. Fakat belirli bir noktadan itibaren düşmeye başlar ve tamamen durur. En iyi çalışabileceği sıcaklığa Optimum Sıcaklık denir. Yüksek sıcaklıklarda enzimler etkisizdirler (genellikle 55-60 °C'de). Bazı ılıcalarda yosunlar 80 °C'de yaşabilirler; fakat bunun üzerindeki sıcaklıklarda enzimleri tamamen koagüle olur ve bir daha etkili hale geçemez. Optimum noktanın biraz üzerinde enzimler etkisiz olmasına karşın, sıcaklık düşünce tekrar etkili hale geçebilirler. Fakat bu sıcaklığın devamı ya da sıcaklığın biraz daha yükselmesi enzimlerin etkinliğini sonsuz olarak ortadan kaldırır. Enzimlerin etkisiz hale geçmeleri ile proteinlerin koagüle olması arasında büyük bir ilişkinin olması, onların, büyük bir kısminin proteinlerden yapıldığım kanıtlar. Doğal olarak enzimler, proteinlerin bir kısmı gibi üçüncül yapıya sahiptir veya en azından moleküllerinin bir kısmı bu yapıdadır. Fakat yüksek sıcaklıklarda bu helozonik ya da üçüncül yapı parçalandığından ya da birbiri üzerine yığıldığından, protein koagüle olur ve enzim etkisiz hale geçer (sütün kaynatılmasında, bakteri enzimlerinin etkisiz hale geçmesi ile ekşime önlenir; bu yoldan teknikte büyük ölçüde yararlanılır; konserve vs. yapımında). Düşük sıcaklıklar enzimin etkinliğini azaltır. 0°C'de enzim ya hiç ya da pek az işlev gösterir; fakat soğuğun enzimin yapışım bozduğu görülmemiştir. Sıcaklık eski hale döndüğünde etkinlik yine başlar (dondurmak suretiyle besin maddelerinin saklanması, yine enzimlerin etkisiz hale geçirilmesiyle sağlanır), insan vücudunda, daha doğrusu sabit sıcaklıklı hayvanlardaki enzimler çoğunluk 37°C'de optimum etkindirler. Daha yüksek sıcaklıklarda (çocuklarda 42, yetişkinlerde 41 °C) enzimler etkisizleşirler; çok defa da koagüle olurlar.
pH
Enzimler pH değişimine karşı çok duyarlıdırlar. Genellikle çok fazla asidik ve alkalik ortamda etkisizdirler. Bazı hallerde enzimler en yüksek etkinliği belirli bir pH derecesinde gösterirler. Bu pH derecesine "Optimum pH" denir. Örneğin, proteini parçalayan pepsin, midenin 2 pH'lık asidik ortamında maksimum çalışır; buna zıt olarak pankreastan salgılanan ve yine protein sindiriminde rol alan tripsin, ancak 8,5 pH'de optimum olarak çalışabilir. pH'la ilgili olmasının nedeni, yapılarında proteinleri taşımalarındandır. Ola ki, pH'a bağlı olarak protein molekülü üzerinde çeşitli elektrik yüklenmeleri ve buna bağlı olarak dış yüz şekli (üçüncül yapı) meydana gelmekte ve substratla-enzim uyuşmasını sağlamaktadır. Belki de bu elektrik yüklenmesi enzim-substrat arasındaki çekiciliği artırmaktadır. Kuvvetli asitler ve bazlar enzimleri koagüle ederler.
Enzim /Substrat Derişimi
Eğer pH ve sıcaklık sabit tutulursa, enzim/substrat derişimi arasındaki orana bağlı olarak bir tepkime hızı görülür. Substratın ya da enzimin fazla olması bu hızı değişik şekillerde etkileyebilir. Bol substrat bulunan bir ortama eklenecek enzim, son ürünün miktarım artıracaktır.
Diğer Kimyasal Maddeler ve Suyun Etkisi
Birçok kimyasal madde enzimleri etkisiz hale getirir; örneğin, siyanit, solunumda önemli rol oynayan sitokrom oksidaz enzimin! etkileyerek inhibe eder (Şekil 2.15/c). Ölüm meydana gelebilir. Florit, glikozu laktik aside çeviren enzim kademelerine etki eder. Hatta enzimin bizzat kendisi zehir etkisi yapabilir; örneğin, 1 mg. kristal tripsin, farenin damarına enjekte edilirse ölüm meydana gelir. Bazı yılan, arı ve akrep zehirleri de enzimatik etki göstererek kan hücrelerin! ya da diğer dokuları tahrip ederler.
Enzimlerin büyük bir kısmı işlevlerini su içerisinde gösterdiklerinden, suyun miktarı da enzim işlevinde etken bir koşuldur. Genellikle % 15'in altında su içeren ortamlarda, enzimler işlev göstermezler. Reçel ve pekmez yapımında bu faktör önemlidir. Sulandırılan reçelin, balın ya da pekmezin vs.nin mayalanması ve ekşimesi bu yüzdendir. Hatta tahıl alımlarında su oranının % 15'in altında istenmesi de bu nedene dayanır.