Genelde dikarboksilik asitler monokarboksilik asitlerle aynı kimyasal davranışları ve tepkimeleri gösterirler. İkinci karboksil grubunun iyonlaşması birincisinden daha zor olur. Bunun nedeni çift yüklü bür anyondan bir hidrojen iyonunun ayrışmasının tek yüklü bir anyondan ayrışmasına kıyasla daha fazla enerji gerektirmesidir.
İki karboksi gruptan biri bir aldehit grubu ile yer değişirse ortaya çıkan bileşik bir "aldehit asit" olarak adlandırılır.
Örnekler
| +Temel dikarboksilik asitler | Genel ismi | IUPAC ismi | Kimyasal formülü | Yapısal formülü |
|---|---|---|---|---|
| Oksalic acid | etandioik asit | HOOC-COOH | ||
| Malonik asit | propandioik asit | HOOC-(CH2)-COOH | ||
| Süksinic asit | butandioik asit | HOOC-(CH2)2-COOH | ||
| Glutarik asit | pentandioic asit | HOOC-(CH2)3-COOH | ||
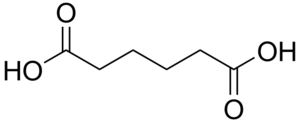
| Adipik asit | heksandioik asit | HOOC-(CH2)4-COOH | ||
| Pimelik asit | heptandioik asit | HOOC-(CH2)5-COOH | ||
| Suberik asit | oktandioik asit | HOOC-(CH2)6-COOH | ||
| Azelaik asit | nonanedioik asit | HOOC-(CH2)7-COOH | ||
| Sebasik asit | dekandioik asit | HOOC-(CH2)8-COOH | ||
| Ftalik asit | benzen-1,2-dikarboksilik asit | C6H4(COOH)2 |