Bu küçüklüğü bir insanın gözünde canlandırması pek mümkün değildir. O yüzden bunu bir örnekle açıklamaya çalışalım:
Yine bu küçüklügü kavraya bilmek ve herseyin nasıl atomlarla dolu olabildigini görebilmek içinbir örnek daha verelim:
Bir tuz tanesinin tüm atomlarını saymak istedigimizi düsünelim.Saniyede bir milyar (1.000.000.000) tane sayacak kadar eliçabuk olduguuzuda varsayalım.Bu dikkate deger beceriye karsın bu ufacık tuz tanesi içindeki atom sayısını tam olarak tesbit edebilmek için besyüz yıldan fazla zamana ihtiyacımz olacaktır.
Peki bu kadar küçük bir yapının içinde ne vardır?
Bu derece küçük olmasına rağmen atomun içinde evrende gördüğümüz sistemle kıyaslayabileceğimiz derecede kusursuz bir sistem bulunmaktadır.
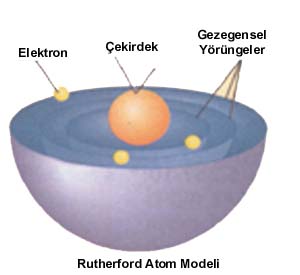
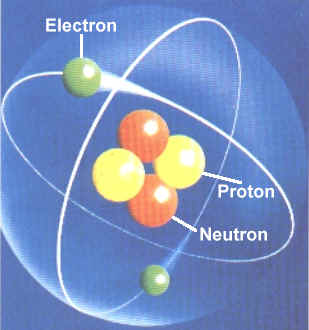
Her atom, bir çekirdek ve çekirdeğin çok uzağındaki yörüngelerde dönüp-dolaşan elektronlardan oluşmuştur.Çekirdeğin içinde ise proton ve nötron ismi verilen başka parçacıklar vardır.
Atomlar
19. yüzyılın başında açıklanan, Dalton'un atom teorisi maddelerin bileşimi ve birleşme oranları hakkında temel gerçekleri aydınlatmıştır. O zamandan beri birçok buluşlar maddenin yapısı hakkında daha ayrıntılı bilgi vermiş olup bu sonuçları şu modern atom teorisinde toplayabiliriz: • Her madde atom denilen çok küçük taneciklerden meydana gelmiştir. • Verilen bir elementin atomları kimyasal olarak aynıdırlar, yani aynı özelliktedir. • Farklı elementlerin atomları kimyasal olarak farklıdır. • Aynı bir elementin atomları her zaman aynı kütleye sahip olmayabilir, fakat aynı elementin her örneği elementin kendine özgü olan bir belirli ortalama atom kütlesine sahiptir. • Atomlar, kimyasal reaksiyonlarla bölünmezler, kaybolmazlar veya başka bir elementin atomuna dönüşmezler. Atomda proton, nötron ve elektron adı verilen üç temel tanecik vardır. Bunların bazıları elektrik yüklü, bazıları ise nötr‘dür.Atom tanecikleri çok küçük olduklarından bunların kütleleri ancak özel yöntemlerle ölçülür. Bu tanecikler için atomik kütle birimi adı verilen kütle birimi (a.k.b) kullanılır. Proton ve nötronun kütlesi 1 a.k.b.dir. Bunu aşağıdaki çizelgede şu şekilde gösterebiliriz.
Tanecik Yükü Kütlesi Proton +1 1 a.k.b Nötron 0 1 a.k.b Elektron -1 0 a.k.b
• Her atom dış kısmını meydana getiren eksi ( negatif) elektrik birimlerinden yani elektronlardan oluşmuştur. Elektronlar her cins atomda bulunurlar, hepsi birbirleri ile aynı kütle ve yüktedirler. Atomlarda elektronlar çekirdek kısmı dışındadırlar. Elektronların yerlerini tam olarak tespit etmek mümkün değildir. Elektronlar çekirdek etrafında sabit bir yol veya yörünge üzerinde hareket etmezler. Elektronların çekirdek etrafında bulunma olasılığının olduğu bölgelere "orbitaller" adı verilir.
•Atomun merkezinde atomun hemen tüm kütlesini meydana getiren artı yüklü çok yoğun bir çekirdek bulunur. Elektron, kütlesi 9,1094 x 10–31 kg olan ve elektriksel olarak (-) eksi yüklü bir parçacıktır. Elektron "e" sembolü ile gösterilir.
Elektronun kütlesi en küçük kütleye sahip hidrojen atomu kütlesinin 1/1837 sidir. Şimdi de çekirdek içinde yer alan parçacıkları ele alalım. Aynı elementin bütün atomları aynı çekirdek yüküne sahiptirler, fakat aynı kütleye sahip olmayabilirler. Çekirdeğin yükü ve kütlesi elementten elemente değişir. Bu nedenle 109 çeşit element bilinmesine karşılık birkaç yüz çeşit çekirdek vardır. Bütün çekirdekler proton ve nötron olmak üzere iki çeşit temel tanecikten yapılmıştır. Proton ve nötrona çekirdekleri inşa edenler anlamına "nükleonlar" adı verilir. Proton, kütlesi 1,6726 x 10–27 Kg olan, bir elektron kütlesinin yaklaşık 1836 katı olan ve elektriksel olarak artı (+) yüklü bir parçacıktır. Proton "p" sembolü veya "H" ile gösterilir. Bir atomdaki protonların toplam sayısı elektronların toplam sayısına eşit olduğundan, normal halde atomlar elektrik yükü bakımından nötrdürler.
İzotoplar
Belli bir elementin bütün elementlerinin atom numarası aynıdır.Fakat bazı elementler kütle numarası bakımından farklılık gösteren çeşitli tipte atomlardan oluşmuştur.Aynı atom numarasına fakat farklı kütle numarasına fakat farklı kütle numarasına sahip atomlara izotop atomlar adı verilir.Görüldüğü gibi izotoplar çekirdeklerindeki nötron sayısı bakımından farklıdırlar;bu da doğal olarak atom kütlelerinin farklı olduğu anlamına gelir.Bir atomun kimyasal özellikleri ilke olarak atom numarası ile belirtilen proton ve elektron sayısına bağlıdır.Bundan dolayı bir elementin izotopları birbiri ile hemen hemen aynı olan kimyasal özelliklere sahiptir.Bazı elementler doğada tek bir izotop halinde bulunurlar.Fakat çoğu elementlerin birden çok izotopu vardır. Örnek olarak kalayın 10 doğal izotopu vardır.
Kütle spektrometresi bir elementte kaç izotop bulunduğunu , her izotopun tam olarak kütlesini ve bağıl miktarını saptamak için kullanılır.Buharlaştırılmış madde , elektronlarla bombardıman edilerek artı yüklü iyonlar oluşturulur.Bu iyonlar eksi yüklü bir levhaya doğru çekilerek bu levha üzerinde bulunan dar bir aralıktan hızla geçirilirler.
İyot demeti bundan sonra magnetik bir alan içinden geçirilir.yüklü tanecikler magnetik bir alan içinde dairesel bir yörünge izlerler.Taneciğin yükü arttıkça doğrusal yörüngesinden sapma da artar.Bu nedenle , magnetik bir alanda artı yüklü bir iyonun izlediği dairesel yörüngenin yarıçapı o iyonun e/m değerine bağlıdır.
Değişik e/m değerine sahip iyonların bu son aralıktan geçmesi ise magnetik alan şiddeti veya iyonları hızlandırmak için kullanılan voltaj ayarlanarak sağlanır.Böylece aygıttaki farklı iyon türlerinden her biri bu aralıktan ayrı ayrı geçirilirler.Detektör her farklı iyon demetinin şiddetini ölçer ; bu iyon şiddeti örnekte bulunan izotopların bağıl miktarına bağlıdır.
Çekirdek

Bu küçüklüğü yine gözümüzde canlandıramayacağımıza göre, kiraz örneğimizden devam edebiliriz. Biraz önceki sayfada bahsettiğimiz gibi elinizdeki anahtarı dünya boyutuna getirdiğimizde ortaya çıkan kiraz büyüklüğündeki atomların içinde çekirdeği arayalım. Ama bu arayış boşunadır, çünkü böyle bir ölçekte de çok daha küçük olan çekirdeği gözlemleme olanağımız kesinlikle bulunamaz. Gerçekten bir şey görebilmek için yine ölçü değiştirmek gerekecektir. Atomumuzu temsil eden kiraz yeniden büyüyüp ikiyüz metre yüksekliğinde kocaman bir top olacaktır. Bu akıl almaz boyuta karşın atomumuzun çekirdeği yine de çok küçük bir toz tanesinden daha iri duruma gelmeyecektir.
Öyle ki, çekirdeğin 10-13cm olan ile atomun 10-5cm olan çapını kıyasladığımızda şöyle bir sonuç ortaya çıkar: Atomu bir küre şeklinde kabul ederek bu küreyi tamamen çekirdekle doldurmak istediğimiz taktirde bu iş için 1015 atom çekirdeği gerekecektir.
Ancak bundan daha şaşırtıcı bir durum vardır;Boyutları 10 milyarda biri olmasına rağmen, çekirdeğin kütlesi atomun kütlesinin %99.95'ni oluşturmaktadır. Peki birşey nasıl olurda bir yandan kütlesinin yaklaşık tamaını oluştururken, diğer yandan da hemen hemen hiç yer kaplamasın?
Bunun sebebi şudur: Atomun kütlesini oluşturan yoğunluk tüm atoma eşit olarak dağılmamıştır, yani atomun bütün kütlesi atomunçekirdeğine birikmiştir. Diyelim ki, sizin 10 milyon m2 bir evimiz var ve bu evin tüm eşyasını 1 m2'lik bir odada toplamanız gerekiyor. Bunu yapabilir misiniz? Tabii ki hayır. Ancak atom çekirdeği dünyada eşi-benzeri, olmayan çok büyük bir güçle bunu yapabilmektedir.
1932 yılına dek, çekirdeğin proton ve elektronlardan oluştuğu sanılıyordu. Ancak yapılan araştırmalarla elektronların değil nötronların atom çekirdeğini oluşturduğu anlaşıldı. Atom çekirdeğine sığabilen bir protonun büyüklüğü ise 10-15 metredir.
Elektronlar
Ancak kuşkusuz, elektronların büyüklüğü dünyanın büyüklüğünden çok farklıdır. Eğer bir kıyas yapmak gerekirse; bir atomu dünya kadar büyütsek, bir elektron sadece bir elma boyutuna gelecektir.
En güçlü mikroskopların bile göremeyeceği kadar küçük bir alanda dönüp-duran onlarca elektron, atomun içinde çok karışık bir trafik yaratır. Ancak, elektronlar atomun içinde en ufak bir kazaya yol açmazlar. Üstelik atomun içinde yaşanacak en ufak bir kaza atom için felaket olabilir ama atom, kendi sonunu getirecek bu felaketi hiçbir zaman yaşamaz ve varlığını sürdürür.
Elektronlar, nötron ve protonların neredeyse ikibinde biri kadar ufaklıkta parçacıklardır. Bir atomda, protonlarla eşit sayıda elektron bulunur ve her elektron her bir protonun taşıdığı artı (+) yüke eşit değerde eksi (-) yük taşır. Çekirdekteki toplam artı (+) yük ile elektronların toplam eksi (-) yükü birbirini dengeler ve atom nötr olur. Elektronların taşıdıkları elektrik yükü itibariyle bazı fizik kurallarına uymaları gerekir. Bu fizik kuralları aynı elektrik yüklerinin birbirini itmesi ve zıt yüklerin birbirlerini çekmesidir. İlk olarak; normal koşullarda hepsi eksi yüklü olan elektronların bu kurala uyup birbirlerini itmeleri ve çekirdeğin etrafından dağılıp-gitmeleri gerekir. Ancak durum böyle olmaz. Eğer, elektronlar çekirdeğin etrafından dağılsalardı, tüm evren boşlukta dolaşan, proton, nötron ve elektronlardan ibaret olurdu.
Bu durum da tabii olarak evrenin sonunun gelmesine sebep olurdu. kinci olarak; artı yüke sahip olduğu için çekirdeğin, eksi yüklü elektronları kendine çekmesi ve elektronların da çekirdeğe yapışmaları gerekir. Böyle bir durumda da çekirdek bütün elektronları kendine çeker ve atom içine çöker. Ancak bu olumsuzlukların hiçbiri olmaz! Elektronların az önce belirttiğimiz (1.000 km/s) olağanüstü kaçış hızları, bunların birbirlerine uyguladıkları itici kuvvet ve çekirdeğin elektronlara uyguladığı çekim kuvveti o kadar hassas değerler üzerine kurulmuştur ki bu üç zıt etken birbirlerini mükemmel bir şekilde dengelerler. Sonuçta atomdaki bu muazzam sistem dağılıp parçalanmadan sürüp gider. Atoma etki eden bu kuvvetlerden birinin olması gerekenden çok az daha fazla veya az olması atom diye bir kavramın hiç varolmamasına neden olurdu.
Kaynaklar: http://stu.inonu.edu.tr/~e0499229/odev.html