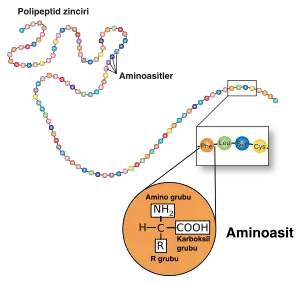
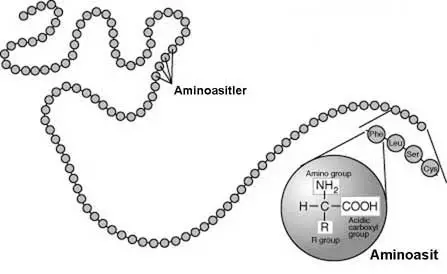
Kimyada bir aminoasit hem amin hem de karboksil fonksiyonel gruplar içeren bir moleküldür. Aminoasitlerin kovalent bağlarla uç uca eklenmesiyle oluşturdukları kısa polimer zincirler "peptid", uzun polimer zincirler ise "polipeptid" veya "protein" olarak adlandırılırlar. Hücre içerisinde ribozomlar, mRNA moleküllerini kalıp olarak kullanarak aminositleri uç uca ekleyerek proteinleri sentezlerler. Bu işleme translasyon (çeviri) denir.
Bahsedilen amino asitlerin hepsinin aynı anda herhangi bir proteinin yapıtaşında bulunması gerekmez. Ayrıca hepsi eşit miktarda da değildir. Proteinlerde bunlardan çok daha farklı amino asitler de bulunabilir. Farklı amino asitler, 20 temel amino asitle oluşturulmuş polipeptidlerin daha sonra “farklılaşmaları” ile oluşur. Bu tür amino asit farklılaşmaları, proteinin özelliklerini ve işlevlerini oldukça fazla değiştirir. Örneğin çözünürlüklerini arttırabilir veya azaltabilir, ya da diğer molekülerle etkileşmelerini düzenleyebilir.
Amino asitlere ek olarak proteinler, çok daha farklı gruplar da barındırabilirler. Amino asit dışında, yapısında farklı türler barındıran amino asitlere, “konjuge proteinler” denir. Konjuge proteinler, kovalent veya non-kovalent bağlarla, nükleik asitlerle nükleoproteinleri, lipidlerle lipoproteinleri, karbonhidratlarla glikoproteinleri ve daha birçok küçük molekül kütleli maddelerle, metallerle ve metal içeren gruplarla kompleks yapılar oluşturabilirler.
Amino Asitlerin Yapısı
Her amino asitin, bir karboksil ve bir de amino grubu vardır. Bu gruplar birbirlerinden α-karbon adı verilen tek bir C atomuyla ayrılırlar. Nötral sulu çözeltilerde α-karboksil grubu bir protonunu kaybeder ve eksi (-) yüklü hale geçer (-COO-). Aynı şekilde α-amino grubuysa bir proton kaybederek artı (+) yüklü olur (-NH3+). Amino asitlerin asimetrik merkezleri (kiral karbonları) vardır. Örneğin Glisin’de, amino asitin α-karbonu dört farklı gruba bağlanabilir. Bu sebepten her amino asit D veya L formunda bulunabilir. Ribozomlar üzerinde amino asit sentezinde her zaman L amino asit kullanılır. Sadece mikroorganizmalar, belli küçük peptidlerin sentezinde D amino asitlerini kullanırlar. İlginç bir örnek olarak, Güney Amerika ağaç kurbağasının derisinde sentezlenen bazı peptidler verilebilir. Bu peptidlerde D amino asitleri bulunmuştur. Bu peptidlerden “dermorphin” , sıçan beynindeki opiate reseptörleri (beyindeki uyuşturucu madde reseptörleri) ile etkileşime girerek oldukça güçlü bir ağrı kesici etki göstermiştir. Bu kurbağaların sentezlediği peptidlerdeki D amino asitleri, peptidde daha önceden bulunan L amino asitleri ile birleşerek enzimleri aktive edebilmektedir.Amino Asit Yan Gruplarının Özellikleri
Polipeptidin ana zinciri, her amino asit için aynı olan grupların birleşimidir. Yan zincir veya R grubu ise, α-karbonuna bağlıdır ve 20 amino asitin her birinde farklıdır. Bu farklılık, proteinin kendine özgü oldukça değişik yapıları ve aktiviteleri kazandırır. Tüm amino asit yan zincirleri bir arada düşünüldüğünde, artı veya eksi yüklüden hidrofobiğe kadar oldukça fazla çeşitli yapısal özellikler gösterirler. Ayrıca bu yan zincirler, oldukça farklı çeşitlilikte kovalent ve nonkovalent bağların yapısına katılabilirler.
Bir enzimin “aktif bölgesi”, birçok farklı organik reaksiyonu katalizleyebilir. Yan zincirlerin çeşitli karakteristiği, molekülün yapısını ve aktivitesini belirleyen molekül içi (intramoleküler) etkileşimlerden, peptidin diğer polipeptidler gibi moleküllerle aralarınddaki ilişkiyi belirlerleyen moleküller arası etkileşimlere kadar birçok şeyi etkiler.
Apolar aminoasitler
Apolar aminoasitler, yan zincirlerinde hidrofobik özellik gösteren radikal grup bulundururlar. Elektrostatik bağlar yapamayan amino asitlerdir. Yan zincirlerinde, genellikle oksijen veya azot yoktur. Öncelikli olarak (bir proteindeki özel bir boşluğa hangi amino asitin en iyi şekilde uyabileceğini belirleyen) büyüklük ve şekillerine göre ayrılırlar. Van der Waals kuvvetleri ve hidrofobik etkileşimler sayesinde bir arada tutunurlar.
Prolin bir iminoasittir, yani amino grubu değil imino grup taşır. Bunu kağıt kromatografisinde farklı renge boyandığından da anlayabiliriz. Her zaman proteinlerin merkezinde gömülü olan aminoasit izolösin'dir.
Polar yüksüz aminoasitler
Polar yüksüz aminoasitler, nötral pH'da yüksüzdürler. Bu gruptaki amino asitlerin yan zincirleri zayıf asit ve bazlardır. Fizyolojik pH’da tamamen yüklü değildirler, ancek kısmi artı (+) ve eksi (-) yükler içerirler. Bu sebeple, su da dahil olmak üzere, diğer moleküllerle H-bağı yapabilirler. Genelde oldukça reaktif amino asitlerdir.
Polar asidik aminoasitler
Polar asidik aminoasitler, fizyolojik pH'da negatif yüklüdürler ve asidik özellik gösterirler.
Polar bazik aminoasitler
Polar bazik aminoasitler, yan zincirlerinde proton alıcı moleküller taşırlar.
Besin maddesi olarak aminoasitler
Proteinlerin yapısını oluşturan 20 amino asit arasında 10 tanesi temel amino asitler olarak adlandırılır. Bu amino asitler insan vücudu tarafından ihtiyacı karşılayacak düzeyde sentezlenemedikleri için dışarıdan beslenme yoluyla alımları zorunludur. Sistein, tirozin, histidin ve arginin çocuklar için yarı zaruri aminoasitler olarak kabul edilmektedirler çünkü bunların sentezlenmesini yürüten metabolik reaksiyonlar çocuklarda tam olarak gelişmemiştir. (*) Sadece özel durumlarda beslenme açısından dışarıdan alımı zaruridir.(Yenidoğanlarda ve üremili hastalarda)
Özellikler
- Prolin bir iminoasittir.
- Histidin kanda tamponlama görevinde kullanılır.
- Tirozin; vücudun rengini veren melanin pigmentinin yapımında, katekolaminlerin sentezinde kullanılır.
- Triptofan serotonin sentezinde rol oynar.
- Aspartat üre döngüsünde ürenin azotlarından birine kaynaklık eder.
- Glutamin toksik amonyağın toksik olmayan depo şeklidir.
- Protein yapısına sadece L-alfa amino asitler katılır.
Kaynakça
- Lippincott Illustrated Reviews Biochemistry
- Harper's Biochemistry
- S. Karp, Molecular Biology and Cell, Wiley & Sons., 1998.
- D. L. Nelson, M. M. Cox, Lehninger Principles of Biochemistry, Freeman and Co., 2005.