Perklorik Asit
Kısaca: Perklorik asit, HClO4, suda çözünebilen renksiz bir sıvı olan bir klor oksoasididir. Sülfürik asit ya da nitrik asit ile kıyaslanabilecek kadar güçlü bir asittir. Perklorik asit bir süper asittir ancak en güçlü Brønsted-Lowry asidi değildir (en güçlüsü HSbF6 ya da floroantimonik asittir). Asidin pKa'sı −7'dir. ...devamı ☟
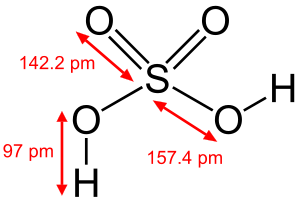
Klorik asit
2 yıl önceklorik asit ve hidrojen klorit üreten, hipokloröz asidin ısıtılmasıdır: 3 HClO → HClO3 + 2 HCl Klorat Hipokloröz asit Kloröz asit Perklorik asit Oksitleyici...
Sodyum perklorat
2 yıl önceSodyum perklorat formülü NaClO4 olan bir kimyasal bileşiktir. Perklorik asitin sodyum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir...
Baryum perklorat
6 yıl önceBaryum perklorat formülü Ba(ClO4)2 olan bir kimyasal bileşiktir. Perklorik asitin baryum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir...
Amonyum Perklorat
2 yıl önceAmonyum perklorat (AP) formülü NH4ClO4 olan bir kimyasal bileşiktir. Perklorik asitin amonyum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir...
Perklorat
2 yıl öncekimyasal kök. Bileşiklerinde daima bir adet elektron alır. Perkloratlar perklorik asitin tuzlarıdır. Perkloratlar özellikle tıpta tiroid bezleri tedavisinde...
Klor
2 yıl önceelektron alma eğilimi gösterirler. Mangandioksit, sodyum klorür ve sülfürik asitin tepkimeye girmesi sonucu klor açığa çıkar ve bu tepkime laboratuvarda klor...
Klor, 1810, Aktinyum, Altın, Alüminyum, Amerikyum, Antimon, Argon, Arsenik, Astatin, Atom numarasıAstatin
2 yıl öncetrioksit hedefi, yoğun nitrik asit ya da perklorik asit gibi bir çözücü içinde çözülür. Bu işlemin ardından damıtılan asit, hem bizmut hem de elde edilmek istenen...
Periyodik Cetvel, Atom numarası, Element, Kimya, Radyoaktif, Taslak, İzotopFransiyum
2 yıl öncesağlayan, taşıyıcı herhangi bir alkali metal olmadan tungosilik asit ve perklorik asit ile de kopresipitasyon gerçekleştirebilir. Neredeyse bütün fransiyum...
Fransiyum, Alkali metal, Atom numarası, Erime noktası, Kaynama noktası, Kimya, Periyodik cetvel, Taslak, Marguerite Perey, Atom ağırlığı