1817 yılında Johann Dobereiner benzer kimyasal özellikler sahip olan stronsiyum, kalsiyum ve baryuma bakarak, stronsiyumun atom ağırlığının kalsiyum ve baryum atom ağırlıklarının ortasında olduğuna dikkat çekti. 1829 yılında klor, brom ve iyot üçlüsünün de benzer özellikler gösterdiği bulundu. Yine benzer davranış lityum, sodyum ve potasyum için de gözleniyordu. 1829 ve 1858 yılları arasında bu konuda pek çok araştırma yapıldı. Bu sırada halojenler grubuna katıldı. Oksijen, kükürt, selenyum ve tellür bir grubun üyesi olarak düşünülürken azot, fosfor, arsenik, antimon ve bizmut başka bir grup içine yerleştirildiler.

İngiliz kimyacı John Newlands 1863 yazdığı bir yazıda benzer fiziksel özelliklere göre elementleri 11 gruba ayırmıştı. Atom ağırlıkları sekizin katı kadar olan elementlerin özellikleri benzerdi. 1864 yılında yazılan bir yazıda Newlands bunu Oktav kanunu (Law of Octaves) olarak tanımladı. Bu kanuna göre herhangi bir element tablodaki sekizinci elementle benzerlikler gösteriyordu.
Genelde periyodik tablonun babası olarak Alman bilim adamı Lother Meyer ve Rus bilim adamı Dmitri Mendeleev kabul edilir. Her ikisi de birbirinden habersi olarak dikkate değer benzer sonuçlar ürettiler. Mendeleev atomların artan atom ağırlıklarına göre sıralandıklarında belli özelliklerin tekrarlandığını görmüştür. Daha sonra elementleri tekrarlanan özelliklerine göre alt alta sıralayarak ilk iki periyodu yedişer, sonraki üç periyodu ise onyedişer element içeren bir periyodik sistem hazırlamıştır. Mendeleevin hazırladığı periyodik sistemde bazı yerleri henüz keşfedilmemiş elementlerin olduğunu düşünerek boş bırakmıştır. Daha sonra bulunan skandiyum, galyum, germanyum elementleri tablodaki boşluklara yerleşmişlerdir.
1895 yılında Lord Rayleigh, kimyasal olarak inert yeni bir gazı (argon) keşfettiğini bildirdi. Bu element periyodik tabloda bilinen hiçbir yere oturtulamadı. 1898 yılında William Ramsey bu elementin klor ile potasyum arasında bir yere konulabileceğini önerdi. Helyumda aynı grubun bir üyesi olarak düşünüldü. Bu grup elementlerinin değerliklerinin sıfır olması nedeniyle sıfır grubu olarak adlandırıldı.
Mendeleevin periyodik tablosu her ne kadar elementlerin periyodik özelliklerini gösterse de neden özelliklerin tekrarlandığı konusunda herhangi bir bilgi vermemektedir.
1911 de Ernest Rutherford atom çekirdekleri alfa parçacıklarının saçılması deneyiyle çekirdek yükünün belirlenebileceğini gösterdi. Rutherfordun gösterdiği diğer bir şey bir çekirdeğin yükünün atom ağırlığı ile orantılı olduğuydu. Yine 1911 de A. Van den Broek bir seri çalışmasıyla elementlerin atom ağırlıklarının atom üzerindeki yüke yaklaşık eşit olduğunu gösterdi. Bu yük daha sonra atom numarası olarak tanımlandı ve periyodik tablodaki elementleri yerleştirmede kullanıldı. 1913 de Henry Moseley bir grup elementin X-ışınlar spektrum çizgilerin dalga boylarını ölçerek, atom numarası ile elementlerin X-ışınları dalga boylarının ilişkili olduğunu gösterdi. Bu çalışma Mendeleev, Mayer ve diğerlerinin yaptığı gibi atom ağırlıklarını temel seçmedeki yanlışlığı gösteriyordu.
Fakat neden periyodik özellikler gözleniyor sorusunun yanıtı ise Niels Bohr un elementlerdeki elektronik yapıyı incelemesiyle başlar diyebilir.
Periyodik tablodaki en son büyük değişiklik, 20. yüzyılın ortalarında Glenn Seaborgun çalışmasıyla ortaya çıktı. 1940 da plutonyumu bulmasıyla başlayan araştırması, 94 den 102 ye kadar olan tüm uranyum ötesi elementlerin bulmasıyla sürdü. Periyodik tablodaki lantanit serisinin altına aktinitler serisini yerleştirdi. 1951 de Seaborg bu çalışmaları ile kimyada Nobel ödülünü kazandı. 106 nolu element seaborgiyum (Sg) olarak adlandırıldı.
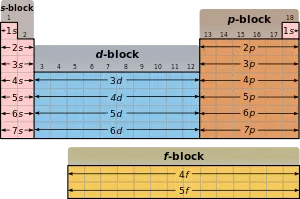
- Periyodik cetvel elementlerin elektron dizilişine bağlı olarak dört bloktan meydana gelir. Cetvelde yatay sütunlara periyot, düşey sütunlara grup denir.Periyodik cetvel 7 periyot ile 8A, 8B grubu olmak üzere 16 gruptan oluşur. 4. ve 5. periyotlarda periyodun 10 element uzamasına d orbitalinin dolması neden olur. 6. ve 7. periyotlarda ise sıranın 14 element uzamasına f orbitalinin dolması neden olur. F orbitaline elektron dolan 14 elementten 6. sıradaki lantanitler ve 7. sıradaki aktinitler, cetvelin daha fazla uzamaması için alt sırada f bloğuna alınmıştır.
- Periyodik cetvelin s bloğunda IA ve IIA, p bloğunda IIIA, IVA, VA, VIA, VIIA ve 0 grupları, d bloğunda ise IIIB, IVB, VB, VIB, VIIB, VIIIB, IB ve IIB grupları yer alır.
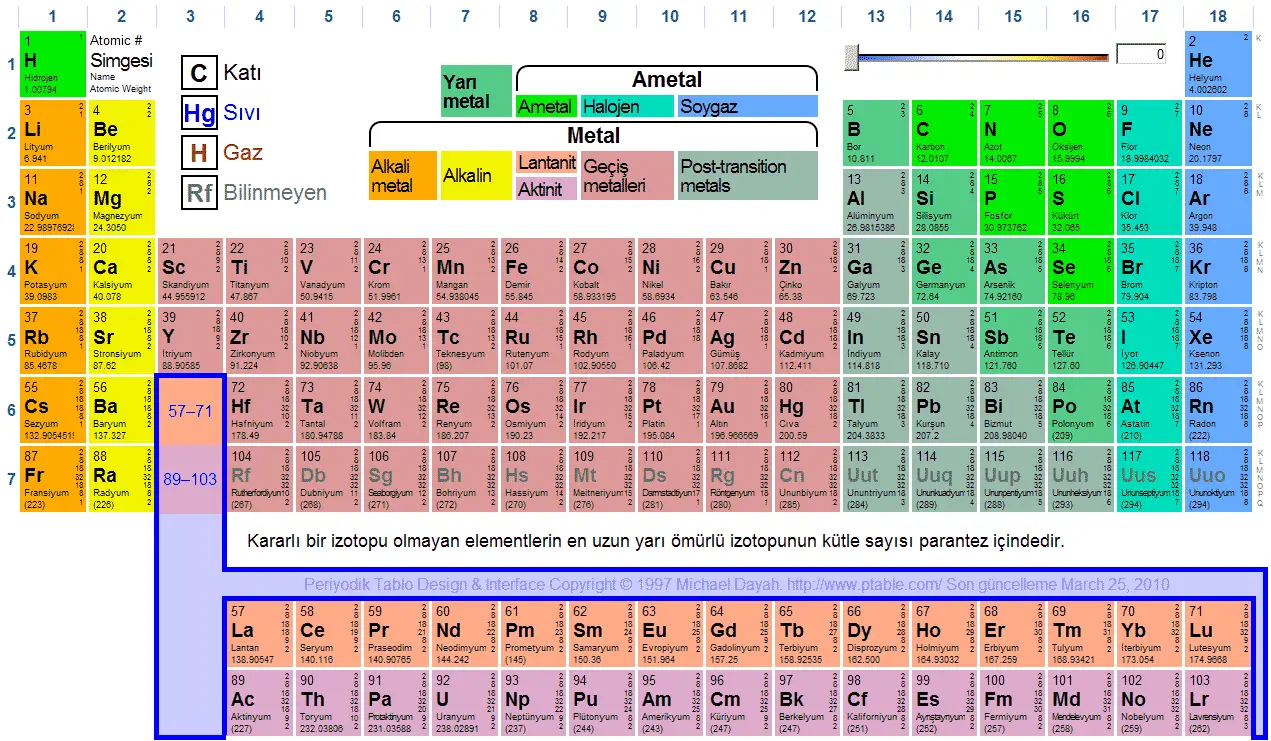
- Elementler artan atom numaralarına göre periyodik cetvele yerleştirildiğinde, cetvelin sol tarafında metallerin sağ tarafında ametallerin yer aldığı görülür.
Ana Özellikleri: (Görünüm Özellikleri) 1- Periyodik cetvel 4 ana bloktan oluşmuştur; s, p, d ve f 2- Periyodik cetvelde, her biri bir enerji seviyesine karşılık gelen 7 tane periyot (satır) vardır. 3- Periyodik cetvelde 8 tane A ve 8 tane B olmak üzere toplam 16 tane GRUP var. Ancak 8B grubu 3 sütundan oluşmuştur. 4- Birinci periyot hariç her periyot bir alkali metal ile başlar. Her periyot bir soy gaz ile biter. (IA grubundaki H aslında başlı başına bir gruptur. Ancak bir çok özelliği IAya yakın olduğundan bu grupta gösterilir.) 5- B gruplarının genel adı GEÇİŞ ELEMENTLERİ olarak adlandırılır. 6- Periyodik cetvelin altındaki f bloğu ise İÇ GEÇİŞ ELEMENTLERİ olarak adlandırılır. Alt grupları ise LANTANİTLER ve AKTİNİTLERDİR 7- Metaller ve a-Metaller 8- Periyodik cetvelin;
1. PERİYOTTA = 2 ELEMENT 2. PERİYOTTA = 8 ELEMENT 3. PERİYOTTA = 8 ELEMENT 4. PERİYOTTA = 18 ELEMENT 5. PERİYOTTA = 18 ELEMENT 6. PERİYOTTA = 32 ELEMENT 7. PERİYOTTA = 32 ELEMENT
Bulunur. Ayrıca Lantanit ve Aktinit serisinde de 14er element bulunur. Bunlar 6 ve 7. periyot elementlerindir
(Kimyasal Özellikleri)
SOLDAN → SAĞA doğru
1. Atom numarası artar.
2. Kütle numarası artar
3. Değerlik elektron sayısı artar.
4. İyonlaşma enerjisi artar.
5. Ametalik özellik artar.
a) Elektron alma isteği artar.
b) Oksitli bileşiklerinin sulu çözeltisinde asit özelliği artar.
c) Hidrojenli bileşiklerinde asit özelliği artar.
d) Ametalik aktiflik artar.
6. Son enerji seviyesi değişmez. 7. Atom hacmi azalır.
| Grup | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Periyot | |||||||||||||||||||
| 1 | 1 H | 2 He | |||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | |||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | |||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | |
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | |
| 6 | 55 Cs | 56 Ba | 71 Lu | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn | |
| 7 | 87 Fr | 88 Ra | 103 Lr | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Uuu | 112 Cp | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |
| Lantanitler | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | |||||
| Aktinitler | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | |||||
| Alkalimetaller | Alkalinler | Lantanitler | Aktinitler | Geçiş metalleri |
| Metaller | Metaloidler | Ametaller | Halojenler | Asilgazlar |